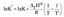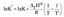otázka  |
Odpoveď  |
podaj jednostkę pojemności cieplnej začať sa učiť
|
|
|
|
|
według III zasadzie termodynamiki entropia każdej substancji tworzącej kryształ w T=0 jest równa začať sa učiť
|
|
|
|
|
Układ zamknięty nieizolowany co może wymieniać a co nie? začať sa učiť
|
|
może wymieniać energie(ciepło i praca), nie może wymieniać masy
|
|
|
zmiana energii wewnętrznej układu zamkniętego nieizolowanego może się dokonać zgodnie z I zasadą termodynamiki wzór na zmianę U: začať sa učiť
|
|
|
|
|
|
začať sa učiť
|
|
|
|
|
I zasadę termodynamiki (prawo o zachowaniu energii) opisuje wzór: začať sa učiť
|
|
|
|
|
I zasada termodynamiki to začať sa učiť
|
|
stwierdzenie, że energii nie można wytworzyć ani zniszczyć nosi nazwę prawa zachowania energii
|
|
|
wzory na entalpię swobodną (G) (3) začať sa učiť
|
|
G=U+pV-TS; G=H-TS; G=F+pV
|
|
|
O zmianach entalpii swobodnej w zależności od temperatury decyduje: začať sa učiť
|
|
|
|
|
co można wyznaczyć za pomocą wzoru ∆G=-RTlnK začať sa učiť
|
|
przewidywać wartość stałej równowagi K na podstawie funkcji termodynamicznych; pozwala obliczyć standardową entalpię swobodną reakcji na podstawie wyznaczonej doświadczalnie stałej równowagi reakcji K
|
|
|
dla układu najbardziej uporządkowanego (kryształ) wg równania Plancka W=... začať sa učiť
|
|
|
|
|
czego wyznaczenie umożliwia równanie van’t Hoffa? začať sa učiť
|
|
wyznaczenie ∆H w dowolnej temperaturze
|
|
|
|
začať sa učiť
|
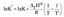 |
jedną z postaci równania van't Hoffa
|
|
|
kiedy Wobj=-∆nRT to praca gazu rozprężającego jest začať sa učiť
|
|
odwracalna w warunkach izotermicznych
|
|
|
w samodzielnie zachodzących przemianach fazowych lub przy powstawaniu roztworów określony składnik układu przechodzi z fazy o ... potencjale do fazy o ... potencjale chemicznym začať sa učiť
|
|
|
|
|
w samodzielnie zachodzących przemianach fazowych lub przy powstawaniu roztworów określony składnik układu przechodzi z jednej fazy do drugiejw jednym czy obu kierunkach? začať sa učiť
|
|
|
|
|
równanie Plancka S=KlnW, jeśli entropia każdej substancji tworzącej kryształ doskonały jest równa zeru to T= začať sa učiť
|
|
|
|
|
jeżeli w układzie o stałym ciśnieniu oznaczamy utracone lub uzyskane ciepło Q (Q>0 lub Q<0) to oznaczamy začať sa učiť
|
|
|
|
|
mierząc energię dostarczoną do układu o stałej objętości jako ciepło lub pobrana z układu w trakcie przemiany, to w rzeczywistości wyznaczamy začať sa učiť
|
|
zmianę energii wewnętrznej ∆U
|
|
|
produkcja entropii w procesie odwracalnym (dS...0) začať sa učiť
|
|
|
|
|
produkcja entropii w procesie nieodwracalnym samorzutnym (dS...0) začať sa učiť
|
|
|
|
|